1. Pembuatan Halogen
Semua unsur
halogen ditemukan di alam dalam bentuk senyawanya. Hal ini disebabkan karena
unsur-unsur halogen bersifat sangat reaktif akibat dari keelektronegatifannya yang
besar, bahkan paling besar di antara semua golongan unsur yang ada. Garam dari
air laut adalah sumber utama unsur-unsur halogen.
Unsur halogen
bereaksi autoredoks dengan air. Kecuali
flourin (F2) bereaksi dengan air membentuk asam halida dan gas
oksigen. Semua unsur halogen
bereaksi dengan logam membentuk garam halida. Hidrokrabon tak jenuh
(mempunyai ikatan rangkap) akan mengalami reaksi adisi bila direaksikan dengan
unsur-unsur halogen. Unsur-unsur
halogen bila bereaksi dengan sesamanya akan membentuk senyawa interhalogen. Berikut adalah reaksi-reaksinya:
Ada
beberapa teknik untuk mendapatkan unsur-unsur halogen. Khusus untuk flourin
diperoleh dari elektrolisis KHF2. Cl2, Br2,
dan I2 dapat diperoleh dari reaksi pendesakan, reaksi oksidasi garam
halidanya dengan KMnO4/MnO2, dan atau elektrolisis
larutan/lelehan garamnya. Untuk Cl2 dapat juga diperoleh dari Downs,
Gibbs, Deacon, dan Dows.
#elektrolisis
KHF2:
#reaksi
pendesakan dengan berpatokan pada deret oksidator: F2>Cl2>Br2>I2:
Asam
dari unsur halogen ada dua macam, yaitu asam halida (HX) dan
asam oksihalogen
(HXO). Untuk membuat asam halida dilakukan dengan
tiga cara, yaitu:
Urutan tingkat keasaman dari asam halida adalah HI>HBr>HCl>HI.
Tingkat keasaman asam halida dipengaruhi oleh jari-jari unsur halogennya.
Makin besar jari-jari atomnya, maka gaya tarik inti terhadap pasangan elektron ikatan makin lemah, sehingga atom H mudah lepas dari molekul asam halidanya. Atom H mudah dilepas itu menunjukan larutan senyawa halida makin asam karena dalam larutan makin banyak mengandung ion-ion H+.
Adapun urutan tingkat keasaman asam oksihalogen adalah HClO>HBrO>HIO. Yang mempengaruhi tingkat keasamannya adalah keelektronegatifannya. Yang sifatnya lebih elektronegatif akan memiliki sifat lebih asam. Kalau asam oksihalogen dibentuk dari unsur halogen yang sama, maka yang mempengaruhi tingkat keasamannya adalah jumlah atom O yang diikat. Makin banyak jumlah atom O yang diikat, maka sifatnya akan semakin asam. Jadi urutan tingkat keasamannya (misalnya senyawa oksihalogen dari atom Cl) adalah HClO4>HClO3>HClO2>HClO.
tiga cara, yaitu:
Urutan tingkat keasaman dari asam halida adalah HI>HBr>HCl>HI.
Tingkat keasaman asam halida dipengaruhi oleh jari-jari unsur halogennya.
Makin besar jari-jari atomnya, maka gaya tarik inti terhadap pasangan elektron ikatan makin lemah, sehingga atom H mudah lepas dari molekul asam halidanya. Atom H mudah dilepas itu menunjukan larutan senyawa halida makin asam karena dalam larutan makin banyak mengandung ion-ion H+.
Adapun urutan tingkat keasaman asam oksihalogen adalah HClO>HBrO>HIO. Yang mempengaruhi tingkat keasamannya adalah keelektronegatifannya. Yang sifatnya lebih elektronegatif akan memiliki sifat lebih asam. Kalau asam oksihalogen dibentuk dari unsur halogen yang sama, maka yang mempengaruhi tingkat keasamannya adalah jumlah atom O yang diikat. Makin banyak jumlah atom O yang diikat, maka sifatnya akan semakin asam. Jadi urutan tingkat keasamannya (misalnya senyawa oksihalogen dari atom Cl) adalah HClO4>HClO3>HClO2>HClO.
2. Pembuatan Alkali(IA) dan Alkali Tanah (IIA)
Alkali
dan alkali tanah bersumber dari air laut, batuan, dan peluruhan unsur
radioaktif. Litium diperoleh dari batuan spodumen (LiAl(SiO3)2,
natrium dari air laut berupa garam dapur (NaCl) dan dari sendawa chili (NaNO3),
Kalium dari batuan karnalit (KCl.MgCl2), sesium dari pollusit
(CsAl(SiO3)2) dan fransium dari luruhan Ac-277 dengan
emisi sinar alfa. Berilium
diperoleh dari beril (Be3Al2Si8O18),
magensium dari magnesit (MgCO3) dan dolomit/cangkang telur (MgCO3.CaCO3),
kalsium dari batu kapur (CaCO3) dan gips (CaSO42H2O),
stronsium dari stronsianit (SrCO3), barium dari barit (BaSO4)
dan witerit (BaCO3), dan radium dari luruhan Th-230 dengan memancar
sinar alfa.
Di alam, unsur-unsur alkali dan alkali tanah berada dalam bentuk senyawanya. Hal ini di sebabkan karena alkali dan alkali tanah besifat sangat reaktif, mudah teroksidasi sehingga keadaannya akan selalu bersenyawa dengan atom-atom unsur lain. Kereaktifan dan kemudahan teroksidasi unsur-unsur alkali dan alkali tanah disebabkan oleh energi ionisasi dan potensial reduksi standarnya (E0) yang kecil. Baik alkali maupun alkali tanah bereaksi dengan air dingin, kecuali Be tidak bereaksi dengan air dan Mg bereaksi dengan air panas. Hasil reaksi antara air dengan alkali/alkali tanah adalah senyawa basa dan gas hidrogren. Berikut adalah persamaan reaksinya:
Di alam, unsur-unsur alkali dan alkali tanah berada dalam bentuk senyawanya. Hal ini di sebabkan karena alkali dan alkali tanah besifat sangat reaktif, mudah teroksidasi sehingga keadaannya akan selalu bersenyawa dengan atom-atom unsur lain. Kereaktifan dan kemudahan teroksidasi unsur-unsur alkali dan alkali tanah disebabkan oleh energi ionisasi dan potensial reduksi standarnya (E0) yang kecil. Baik alkali maupun alkali tanah bereaksi dengan air dingin, kecuali Be tidak bereaksi dengan air dan Mg bereaksi dengan air panas. Hasil reaksi antara air dengan alkali/alkali tanah adalah senyawa basa dan gas hidrogren. Berikut adalah persamaan reaksinya:
Reaksi alkali
dan alkali tanah dengan O2 akan membentuk tiga jenis senyawa, yaitu
senyawa oksida (biloks O=-2), peroksida (biloks O=-1), dan superoksida (biloks
O=-1/2).
Reaksi
dengan H2 membentuk senyawa hidrida. Reaksi dengan unsur halogen
membentuk garam halida. Reaksi dengan asam membentuk garam halida dan gas
hidrogen. Semua alkali tanah bereaksi dengan gas nitrogen membentuk garam nitrida. Dari unsur alkali, hanya Li yang dapat bereaksi
dengan N2 membentuk garam nitrida/LiN3.
dengan N2 membentuk garam nitrida/LiN3.
Uji nyala alkali dan alkli tanah memberikan warna yang khas untuk setiap unsurnya. Dalam uji nyalanya unsur-unsur alkali: Li berwarna merah, Na berwarna kuning, K berwarna bungur, Rb berwarna kuning biru, Cs berwarna biru dan unsur-unsur alkali tanah: Ca berwarna orange, Sr berwarna merah, dan Ba berwarna hijau.

Dalam uji kelarutan garamnya dalam air, semua garam IA larut dalam air kecuali LiF dan Li2CO3. Adapun garam-garam IIA, kelarutannya dalam air mengikuti pola-pola berikut:
Untuk
mendapatkan unsur-unsur alkali dan alkali tanah hanya bisa dilakukan dengan elektrolisis lelehan garamnya saja. Elektrolisis lelehan garam NaCl dan LiCl
untuk mendapatkan Li dan Na disebut proses Downs dan elektrolisis lelehan garam
MgCl2 untuk mendapatkan Mg disebut proses Dow.
3. Pembuatan Aluminium
Pengolahan
aluminium menjadi aluminium murni bisa dilakukan melalui 2 tahap yaitu:
1. Tahap pemurnian bauksit sampai diperoleh aluminium oksida murni
(alumina)
Tahap
pemurnian bauksit dilakukan untuk menghilangkan pengotor utama dalam bauksit.
Pengotor utama bauksit biasanya terdiri dari SiO2, Fe2O3, dan TiO2. Caranya
adalah dengan melarutkan bauksit dalam larutan natrium hidroksida (NaOH),
Al2O3 (s) + 2NaOH (aq) + 3H2O(l) ---> 2NaAl(OH)4(aq)
Aluminium
oksida larut dalam NaOH sedangkan pengotornya tidak larut. Pengotor-pengotor
dapat dipisahkan melalui proses penyaringan. Selanjutnya aluminium diendapkan
dari filtratnya dengan cara mengalirkan gas CO2 dan pengenceran.
2NaAl(OH)4(aq) + CO2(g) ---> 2Al(OH)3(s) + Na2CO3(aq) + H2O(l)
Endapan
aluminium hidroksida disaring,dikeringkan lalu dipanaskan sehingga diperoleh
aluminium oksida murni (Al2O3)
2Al(OH)3(s) ---> Al2O3(s) + 3H2O(g)
2. Tahap
peleburan alumina
Selanjutnya
adalah tahap peleburan alumina dengan cara reduksi melalui proses elektrolisis
menurut proses Hall-Heroult. Dalam proses Hall-Heroult, aluminum oksida
dilarutkan dalam lelehan kriolit (Na3AlF6) dalam bejana baja berlapis grafit
yang sekaligus berfungsi sebagai katode. Selanjutnya elektrolisis dilakukan pada
suhu 950 oC. Sebagai anode digunakan batang grafit.
Bauksit
banyak terdapat di daerah Bintan dan kalimantan. Cara penambangan terbuka.
Bauksit kemudian dihaluskan , dicuci dan dikeringkan, sesudah itu bauksit
mengalami pemurnian menjadi oksida aluminum atau alumina.
4. Pembuatan Silikon
Silikon
dibuat dengan mereduksi kuarsa (quartz) atau sering disebut juga dengan silika
ataupun silikon dioksida dengan kokas (C). Proses reduksi ini dilangsungkan di
dalam tungku listrik pada suhu 3000 °C. Reaksi yang terjadi adalah:
SiO2(l) +
2C(s) –––→ Si(l) + 2CO2
|
Silikon yang
diperoleh kemudian didinginkan sehingga diperoleh padatan silikon. Namun
silikon yang diperoleh dengan cara ini belum dalam keadaan murni. Agar
diperoleh silikon dalam bentuk murni diawali dengan mereaksikan padatan silikon
yang diperoleh melalui cara di atas direaksikan dengan gas klorin (Cl2), sesuai
reaksi berikut:
Si(s) + Cl2(g) –––→ SiCl4(g)
Gas SiCl4
ini mememiliki titik didih 58 °C. Uap yang terbentuk kemudian dilewatkan
melalui sebuah tabung panas berisi gas H2 sehingga terbentuk Si, berikut
reaksinya:
SiCl4(g) + 2H2(g) –––→ Si(s) + 4HCl(g)
Padatan Si
yang terbentuk berupa batangan yang perlu dimurnikan lebih lanjut denan cara
pemurnian zona (zona refining).
5. Pembuatan Fosfor
Sumber utama
industry fosfor adalah Ca3(PO4)2. Dalam prosesnya, Ca3(PO4)2 dicampur dengan
karbon dan silika (SiO2) pada temperature 1400⁰C - 1500⁰C (dengan
bunga api listrik). SiO2 bereaksi dengan Ca3(PO4)2 pada temperature tersebut
mengahasilkan P4O10 (g).
Reaksinya sebagai berikut :
Reaksinya sebagai berikut :
2 Ca3(PO4)2
(l) + 6 SiO2 (l) → 6 CaSiO3 (l) + P4O10 (g)
Kemudian , P4O10
(g) direduksi dengan karbon , reaksinya sebagai berikut :
P4O10 (g) +
C (s) → P4 (g) + 10 CO2 (g)
P4 (g) yang
terjadi dikristalkan dan disimpan di dalam CS2 cair atau di dalam air. Hal itu
guna menghindari terjadinya oksidasi dengan oksigen dari udara yang cepat
terjadi pada temperatur 30⁰C berupa nyala fosfor. P4 hasil pengolahan merupakan
salah satu bentuk alotropi fosfor, yaitu fosfor putih.
6. Pembuatan Belerang
a. Proses
Frasch
Cara frasch
adalah mengambil belerang dari deposit belerang di bawah tanah, pompa frasch
dirancang oleh Herman Frasch dari Amerika Serikat tahun 1904.
Pada proses ini pipa logam berdiameter 15 cm yang
terdapat 2 pipa konsentrik yang lebih kecil ditanam sampai menyentuh lapisan
belerang. Uap air yang sangat panas dipompa dan dimasukan melalui pipa luar,
sehingga belerang meleleh. Kemudian dimasukan udara bertekanan tinggi melalui
pipa terkecil, sehingga terbentuk busa belerang dan terpompa ke atas melalui
pipa ketiga. Kemurnian belerang yang keluar mencapai 99,5%. Pada dewasa
ini 50% belerang yang digunakan dalam industri diperoleh dengan proses frasch
b. Proses
kontak
Pada
pembuatan belerang dengan proses kontak bahan baku yang digunakan belerang,
udara dan air.
S(s)+O2(g)
SO2(aq)
2SO2(g)+O2(g)↔2SO3(g)
SO3(g)+H2O(l)→H2SO4(aq)
Pertama-tama belerang padat dimasukan kedalam drum berputar lalu
dibakar dengan oksigen dari udara dan hasilnya gas SO2 dimurnikan dengan
pengendap elektrostatika ( kawat-kawat betegangan tinggi ) partikel-partikel
debu dan kotoran lain menjadi bermuatan dan tertarik oleh kawat yang muatannya
berlawanan, sehingga debu-debu itu jatuh kelantai ruangan.
Campuran gas SO2 dan udara kemudian dialirkan kedalam ruangan yang
dilengkapi katalis serbuk V2O5. Disini berlangsung proses kontak yaitu kontak
antara campuran gas-gas dengan katalis. Gas SO2 bereaksi dengan oksigen dengan
udara untuk membentuk gas SO3.
2SO2(g)+O2(g)↔2SO3(g)
∆H = -90 kJ
Agar reaksi ini bergeser kekanan gas SO3 yang terbentuk segera
direaksikan dengan air untuk menghasilkan H2SO4
SO3(g)+H2O(l)→
H2SO4(aq)
Gas SO3 direaksikan dengan H2SO4 untuk membentuk asam pirosulfat,
H2S2O7 kemudian barulah asam pirosulfat direaksikan denga air untuk membentuk
asam sulfat SO3¬(g)+H2SO4(aq) →H2S2O7(aq)
H2S2O7(aq)+H2O→2H2SO4¬(aq)
7. Pembuatan Oksigen
Oksigen dapat dibuat dalam skala
besar di industri dan dapat juga dalam skala kecil di laboratorium. Dalam skala
besar di industri, pembuatan oksigen diperoleh dari destilasi bertingkat udara
cair. Prosesnya, mula-mula udara disaring untuk menghilangkan debu lalu
dimasukkan ke dalam kompresor. Pada kompresi ini suhu udara akan naik, kemudian
didinginkan dalam pendingin. Udara dingin mengembang melalui celah, dan
hasilnya adalah udara yang suhunya lebih dingin, cukup untuk menyebabkannya
mencair. Udara cair disaring untuk memisahkan karbondioksida dan air yang telah
membeku. Kemudian udara cair itu memasuki bagian puncak kolom di mana nitrogen,
komponen yang paling mudah menguap, keluar sebagai gas. Pada pertengahan kolom,
gas argon keluar dan selanjutnya oksigen cair. Komponen lain yang paling sulit
menguap akan terkumpul di dasar. Berturut-turut titik didih normal nitrogen,
argon, dan oksigen adalah -195,8, -185,7, dan -183,0°C.
8. Pembuatan Nitrogen
a. Filtrasi
Pada saat udara dihisap oleh
kompresor, terlebih dahulu udara disaring dengan menggunakan filter, agar
kotoran atau gas-gas pengotor dari udara bebas dapat disaring dan tidak terikut
dalam proses-proses selanjutnya. Contoh gas pengotor : uap air dan
karbondioksida, debu juga bisa menjadi zat pengotor pada udara bebas. Zat
pengotor ini harus dihilangkan karena dapat menyebabkan penyumbatan pada
perlatan, tingkat bahaya yang dapat ditimbulkan, korosi, dan juga dalam
batas-batas tertentu dilarang terkandung dalam spesifikasi produk akhir.
b. Kompresi
Alat yang digunakan yaitu
compressor, dimana fungsinya yaitu menaikkan tekanan udara bebas yang diserap
sampai 145 – 175 Psig atau sekitar 6 bar.
c. Cooling Water
Air umumnya digunakan sebagai
pendingin pada industri sebab air tersedia jumlahya dan mudah ditangani. Air
juga mampu menyerap sejumlah besar enegi per satuan volume dan tidak mengalami
ekspansi maupun pengerutan dalam rentang temperatur yang biasanya dialaminya.
Sistem penguapan terbuka merupakan tipe sistem pendingin yang umumnya digunakan
dalam plant pemisahan udara.
Sebagian industri menggunakan system direct cooler pada proses pendinginannya, dimana terjadi kontak langsung antara udara dengan air pada sepanjang tray direct cooler. Direct cooler mempunyai kelebihan dari pada proses pendinginan yang menggunakan tube atau shell cooler, dimana temperatur yang bisa dicapai yaitu 2ºC, sedang pada tube atau shell cooler hanya sekitar 8ºC, efek pengguyuran (scrubbing) dari air juga dapat membantu menurunkan kandungan partikel dan menyerap pengotor yang terbawa udara. Namun jika direct cooler tidak terjaga, seperti ∆P tinggi (pada aliran dan udara masuk) dan tinggi cairan (pada aliran air). Oleh karena tingginya perbedaan temperatur yang melalui tray bawah unit, maka pada tray ini sangat mungkin terjadi pembentukan kerak. Untuk alasan itu, water treatment harus bekerja efektif dan tray harus dibersihkan dan diperiksa jika memungkinkan.
Sebagian industri menggunakan system direct cooler pada proses pendinginannya, dimana terjadi kontak langsung antara udara dengan air pada sepanjang tray direct cooler. Direct cooler mempunyai kelebihan dari pada proses pendinginan yang menggunakan tube atau shell cooler, dimana temperatur yang bisa dicapai yaitu 2ºC, sedang pada tube atau shell cooler hanya sekitar 8ºC, efek pengguyuran (scrubbing) dari air juga dapat membantu menurunkan kandungan partikel dan menyerap pengotor yang terbawa udara. Namun jika direct cooler tidak terjaga, seperti ∆P tinggi (pada aliran dan udara masuk) dan tinggi cairan (pada aliran air). Oleh karena tingginya perbedaan temperatur yang melalui tray bawah unit, maka pada tray ini sangat mungkin terjadi pembentukan kerak. Untuk alasan itu, water treatment harus bekerja efektif dan tray harus dibersihkan dan diperiksa jika memungkinkan.
d. Purrification (Pemurnian)
Pada proses ini terdapat proses
penyerapan (adsorpsi) terhadap material/zat-zat pengotor dari feed air ,
diantaranya : uap air, karbon monoksida, karbon dioksida, dan beberapa
kandungan hidrokarbon. Pada beberapa industri, menggunakan 2 layer pada vessel
pemurnian ini, layer bawah menggunakan alumina untuk menyerap/ mengadsorpsi
kandungan uap air dalam udara dan bagian top/atas menggunakan molecular
sieve yang bertindak sebagai adsorben untuk menghilangkan karbondioksida.
e. Heat Exchanger (Pemindah Panas)
Melewati exchanger, udara
didinginkan hingga mendekati titik pencairan. Karena udara menjadi dingin,
mula-mula uap air akan menjadi deposit, dimulai jadi cairan kemudian berubah
menjadi salju halus dengan arah yang berlawanan. Fungsi heat exchanger untuk
memudahkan pergerakan panas yang akan dipindahkan aliran panasnya, dari zat
yang memiliki panas lebih tinggi menuju daerah yang dingin hingga temperature
keduanya sama
f. Ekspansi
Udara yang dingin tersebut
diekspansikan atau diturunkan tekanannya sampai tekanan menjadi 70 – 80 psig
hingga udara tersebut cair.
g. Distilasi
Pada proses ini final terjadi proses
pemisahan antara gas-gas yang terkandung pada udara bebas sebagai umpan melalui
perbedaan titik didih (relative volatilitas). Dimana nitrogen memiliki titik
didih yang lebih tinggi dibandingkan dengan gas-gas lain yang terkandung dalam
udara yaitu -195. Bila dipisahkan masing-masing gas pada proses
vaporisasi (destilasi), maka nitrogen akan cepat menguap dan menghasilkan
produk gas yang siap digunakan. Gas nitrogen yang dihasilkan dari proses
vaporisasi bisa dirubah bentuk menjadi liquid dengan cara dilewatkan pada
kolom-kolom
9. Pembuatan Kromium
Kromium adalah 21 paling banyak unsur dalam kerak bumi dengan
konsentrasi rata-rata 100 ppm. Senyawa Kromium terdapat di dalam
lingkungan, karena erosi dari batuan yang mengandung kromium dan dapat
didistribusikan oleh letusan gunung berapi. Rentang konsentrasi dalam
tanah adalah antara 1 dan 3000 mg / kg, dalam air laut 5-800 μg / liter,
dan di sungai dan danau 26 μg / liter dengan 5,2 mg / liter. Hubungan
antara Cr (III) dan Cr (VI) sangat tergantung pada pH dan oksidatif
sifat lokasi, tetapi dalam banyak kasus, Cr (III) adalah spesies
dominan, meskipun di beberapa daerah di tanah air dapat mengandung
sampai 39 μg dari total kromium dari 30 μg yang hadir sebagai Cr (VI).





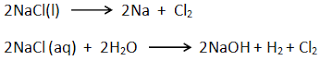



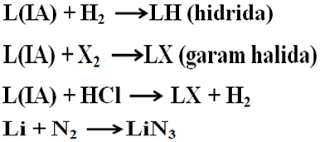







No comments:
Post a Comment